CHAPITRE 1 : LES COMBUSTIONS ET LEURS CONSEQUENCES
I – L'EFFET DE SERRE
Exposé sur l’effet de serre
Activité documentaire à partir de la vidéo « L'effet de serre »
II – COMBUSTION DU CARBONE
Le charbon est essentiellement constitué de …………………………….
Quand on veut allumer un feu, on souffle pour ……………………… (envoyer plus d'air au niveau du foyer).
Rappel de 5ème : l'air est constitué à 78 % de diazote, 21 % de dioxygène et 1 % de nombreux autres gaz présents en faible quantité.
ACTIVITÉ :
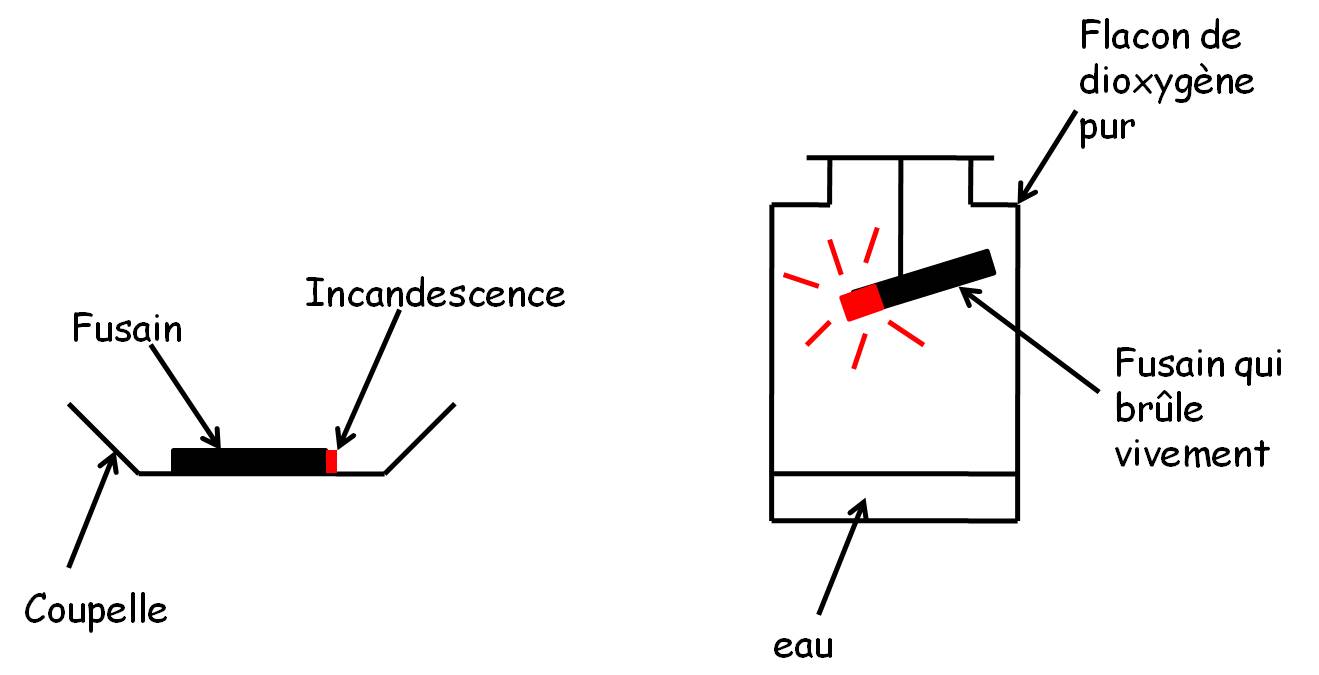
1°) Proposez une expérience qui permettrait de savoir quel gaz contenu dans l'air permet la combustion.
Matériel à disposition :
verrerie de chimie
fusain (charbon de bois, composé principalement de carbone)
flacon de dioxygène
| Compétence évaluée : D4.1.2 : Proposer des hypothèses et concevoir une expérience pour les vérifier | ||||
| | Très bonne maîtrise | Maîtrise satisfaisante | Maîtrise fragile | Maîtrise insuffisante |
| Évaluation élève | | | | |
| Évaluation professeur | | | | |
2°) Si la combustion a eu lieu, comment pouvez-vous vérifier qu'il s'est formé du dioxyde de carbone ?
Aide : l'eau de chaux se trouble en présence de dioxyde de carbone.
Expérience :
| Observations | Interprétation |
| Le carbone brûle vivement dans le dioxygène. L'eau de chaux s'est troublée. Le carbone a disparu. La combustion s'est arrêtée. | C'est le dioxygène qui permet les combustions dans l'air. Il s'est formé du dioxyde de carbone. Il n'y a plus de dioxygène après la combustion. |
Conclusion :
Le carbone brûle dans le dioxygène et cela forme du dioxyde de carbone. C'est une transformation chimique.
Définitions :
Les espèces chimiques qui sont consommées au cours d'une transformation chimique sont appelées réactifs.
Les espèces chimiques qui sont apparaissent au cours d'une transformation chimique sont appelées produits.
Application :
Si on vous confie un flacon contenant un gaz incolore et inconnu, proposez une méthode qui vous permettrait de vérifier s'il s'agit de dioxygène.
| Compétence évaluée : D4.1.2 : Proposer une ou des hypothèses pour répondre à une question scientifique. Concevoir une expérience pour la ou les tester | ||||
| | TBM | MS | MF | MI |
| Eval. Elève | | | | |
| Eval. Prof. | | | | |
III – DANGERS DES COMBUSTIONS
Exposé : le triangle du feu
Pour qu'une combustion ait lieu, il faut réunir trois éléments : un combustible, un comburant et une énergie d'activation. C'est le triangle du feu.
Exposé : combustions incomplètes
Le monoxyde de carbone est un gaz incolore, inodore et mortel qui se dégage lors d'une combustion incomplète.
IV – TRANSFORMATION CHIMIQUE, TRANSFORMATION PHYSIQUE ET MÉLANGE
Rappelez, d'après vos souvenirs de 5ème, à quoi correspond un changement d'état de la matière au niveau microscopique.
Un changement d'état correspond à une modification de la façon dont les molécules sont liées les unes aux autres et se déplacent. Les espèces chimiques ne sont pas modifiées.
Au cours d'une transformation chimique, les molécules sont modifiées car des réactifs disparaissent et de nouvelles molécules apparaissent : les produits.
Au cours d'un mélange, les molécules ne sont pas modifiées.
I - CONSERVATION DE LA MASSE AU COURS D'UNE TRANSFORMATION CHIMIQUE
Activité expérimentale :
En géologie, on utilise de l’acide chlorhydrique pour reconnaître qu’une roche est calcaire car ces deux espèces chimiques réagissent en formant un gaz : le dioxyde de carbone.
1- On introduit de l’acide chlorhydrique au fond d’un erlenmeyer.
2- On met un morceau de calcaire dans un ballon de baudruche.
3- On fixe le ballon à l’ouverture du bécher.
4- On pose l’ensemble sur une balance et on note la masse : …………..
5- On fait tomber le morceau de calcaire dans l’erlenmeyer.
Schéma au cours de l’expérience :
| Observations | Interprétation |
| Il y a une effervescence. La masse ne change pas. | Un gaz se dégage qui est produit par une transformation chimique. La masse des espèces chimiques formées est la même que la masse des espèces chimiques qui disparaissent. |
Conclusion :
Au cours d’une transformation chimique, la masse est conservée : la masse des réactifs qui disparaissent est égale à la masse des produits qui se forment.
II – MOLÉCULES ET ATOMES
Les particules qui constituent la matière sont appelées molécules.
Les molécules sont constituées d'atomes.
| Nom | Symbole | Modèle moléculaire |
| Hydrogène | H | |
| Carbone | C | |
| Oxygène | O | |
Les atomes sont tous répertoriés dans la classification périodique des éléments.
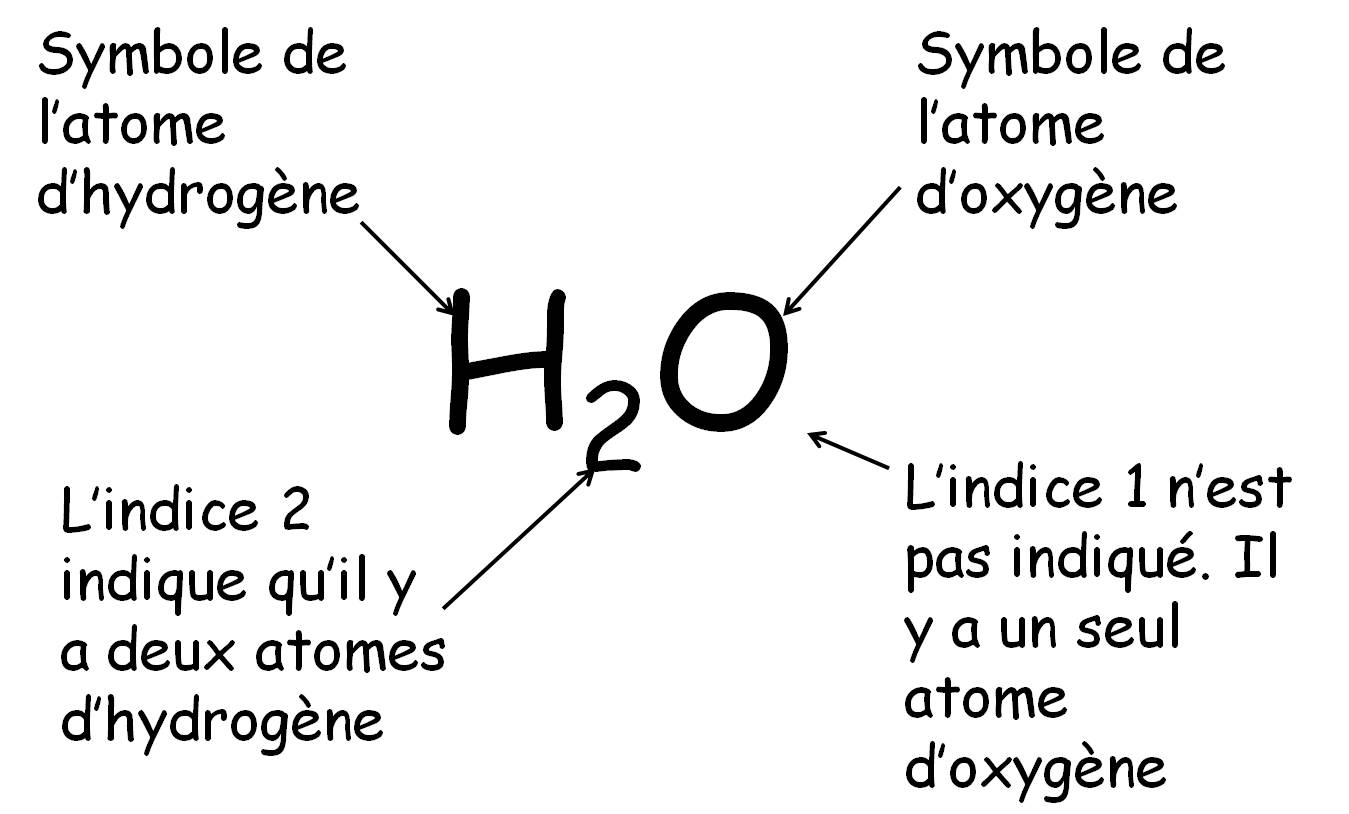
La formule chimique d'une molécule donne sa composition atomique.
Exemple :
la molécule d'eau est constituée de deux atomes d'hydrogène et un atome d'oxygène :
Donnez la composition atomique des molécules suivantes :
Le dihydrogène (H2) :
Le dioxygène (O2) :
Le diazote (N2) :
Le dioxyde de carbone (CO2) :
III – ATOMES ET TRANSFORMATIONS CHIMIQUES
Au cours d'une transformation chimique, on remarque que des molécules disparaissent et de nouvelles apparaissent.
Exemple de la combustion du carbone
Le carbone brûle dans le dioxygène pour former du dioxyde de carbone.
Equation chimique :
carbone + dioxygène dioxyde de carbone
Représentation avec les modèles moléculaires.
Comment expliquer que la masse se conserve au cours d'une transformation chimique ?
Au cours d'une transformation chimique, les atomes qui constituent les molécules se réarrangent différemment au cours d'une transformation chimique.
Equation-bilan :
C + O2 CO2
ACTIVITÉ 1 :
Au sujet des transformations chimiques, Lavoisier ( 1743 - 1794) a dit : « rien ne se perd, rien ne se crée, tout se transforme ». Essayez d'expliquer cette phrase.
ACTIVITÉ 2 :